Der lange Abschied von der unschädlichen Dosisschwelle
Anerkannte Strahleneffekte im Niederdosisbereich und ausstehende Korrekturen
Von Inge Schmitz-Feuerhake, Gesellschaft für Strahlenschutz eV.
Bereits vor langer Zeit wurde das Prinzip des „stochastischen“ Schadens für strahlenbedingte Krebs- und Erbkrankheiten von der internationalen Strahlenschutzkommission ICRP‘ eingeführt. Es sollte den als eher unwahrscheinlich beschriebenen Ernstfall zur sicheren Seite hin abdecken, indem zugestanden wurde, dass ein einzelnes Strahlenquant im Prinzip einen gravierenden Spätschaden auslösen kann. Grenzwerte mussten seitdem stets mit einem entsprechend hohen gesellschaftlichen Nutzen gerechtfertigt werden, da sie reale Schadensfülle zuließen. Anwender und etliche Standesorganisationen sind bis heute gegen dieses Prinzip Sturm gelaufen und nach Fukushima wurde vielstimmig die Behauptung lanciert, unter 100 Millisievert (mSv)2 seien keine statistisch erkennbaren Schäden möglich. Demgegenüber liegen Evidenzen aus den Bereichen vorgeburtliche Röntgendiagnostik, Folgen bei den japanischen Atombombenüberlebenden, Radon in Häusern und berufliche Expositionen vor, die man heute als den akzeptierten Stand der Erkenntnis ansehen muss. Hinzu kommen als Beleg für die Wirksamkeit chronischer Expositionen durch Umweltradioaktivität die Befunde am Fluss Techa im Südural, wo die Bevölkerung durch die Emissionen der Plutoniumaufarbeitungsanlage Mayak kontaminiert wurde.
Umwelteffekte durch andere kerntechnische Anlagen werden jedoch weiterhin offiziell geleugnet. Nachgewiesene Spätfolgen diagnostischer Bestrahlungen von Kindern und Erwachsenen werden nach wie vor ignoriert. Außerdem werden eine ganze Reihe von strahlen bedingten Nicht-Krebserkrankungen, genetischen und teratogenen Schäden nicht berücksichtigt, die insbesondere nach dem Tschernobylunfall auffällig geworden sind.
Einleitung
Unter einer niedrigen Dosis durch ionisierende Strahlen (Radioaktivität und Röntgen) verstehen wir Expositionen in Höhe der natürlichen Umgebungsstrahlung, des diagnostischen Röntgens und der Grenzwerte für berufliche Strahlenbelastungen. Die folgenreichsten Strahlenschäden — genetische Schäden bei den Nachkommen bestrahlter Eltern — waren bereits in den 1920er Jahren durch den späteren Nobelpreisträger Herman Joseph Muller entdeckt worden. Er schloss aus seinen Beobachtungen bei der Taufliege, dass auch geringe Strahlendosen und somit auch die natürliche Umgebungsstrahlung muffigen sind. In den 1930er Jahren bildete sich bereits die Auffassung, dass Krebs infolge einer Zellmutation entsteht, einer „somatischen“ Mutation, und von einer einzigen derart transformierten Zelle ausgeht. Daher schloss Muller, dass es auch für strahleninduzierten Krebs keinen unschädlichen Dosisbereich gibt [Muller 1936].
Die internationale Strahlenschutzkommission ICRP entwickelte daraus später den Begriff des „stochastischen“ Strahlenschadens. Wird ein großes Kollektiv mit einer geringen Dosis bestrahlt, lässt sich nicht vorhersagen, bei welchem Individuum der Schaden eintritt, nur eine Wahrscheinlichkeit lässt sich angeben. Die Anzahl der Schadensfälle steigt mit der Gesamtdosis, jedoch bei jeweils der halben Dosis gibt es immer noch eine erhöhte Schadensrate. Daher gibt es keinen „Schwellenwert“, das heißt keinen unschädlichen Dosisbereich, die Dosis-Wirkungskurve beginnt ab der Dosis Null zu steigen. Strahlenbedingte Krebserkrankungen sowie genetische Krankheiten bei den Nachkommen bestrahlter Eltern werden zu den stochastischen Schäden gerechnet.
Dieser schon lange zurückliegende bedeutsame Schrift der ICRP — die Anerkennung von Gesundheitsgefahren ohne Gewährung eines sicheren Dosisbereichs — ist heute Lehrmeinung in den internationalen Strahlenschutzgremien und auch in der deutschen Strahlenschutzkommission — entgegen früheren oft von offizieller Seite zu hörenden Relativierungen, es handele sich um ein „hypothetisches Risiko“ (das in Wirklichkeit vermutlich gar nicht bestehe), um eine im Sinne des Schutzes der Bürger äußerst vorsichtige Annahme, weil eben bei niedriger Dosis die Effekte allenfalls so selten seien, dass man sie statistisch gar nicht erfassen könne.
Letztere Standpunkte wurden infolge zweier lange Zeit umstrittener Effekte aufgegeben, die in neuerer Zeit als real erkannt worden sind:
- die Bestätigung der in den 1950er Jahren von der englischen Medizinerin Alice Stewart entdeckten Verursachung kindlicher Krebserkrankungen durch diagnostisches Röntgen bei Schwangeren,
- die Erhöhung der Lungenkrebsrate in der Bevölkerung durch die normalen Pegel des radioaktiven Gases Radon in der Atemluft von Wohnhäusern.
Aufgegeben werden musste ferner die lange Zeit gehegte Vorstellung, das bis heute im offiziellen Strahlenschutz vornehmlich herangezogene Referenzkollektiv — die Überlebenden der Atombombenabwürfe auf Hiroshima und Nagasaki — weise nur Daten aus dem Bereich hoher Dosen auf und man müsse daher auf Effekte bei niedriger Dosis herunterextrapolieren. Dies ist nicht der Fall.
Ferner ist es inzwischen Konsens in der Strahlenforschung, dass beruflich strahlenexponierte Kohorten unterhalb der amtlichen Grenzwerte signifikant erhöhte und dosisabhängige Spätschäden zeigen.
Im Folgenden werden zu diesen Themenbereichen genauere Ausflihrungen gemacht, die zeigen, dass das Beharren auf einer Dosisschwelle in Höhe von 100 Millisievert (mSv) dem erreichten internationalen Stand der Wissenschaft nicht entspricht und als Irreführung und Propaganda von interessierter Seite einzuordnen ist.
I Die späte Anerkennung der Befunde nach diagnostischem Röntgen von Schwangeren
In den 1950er Jahren hatte die englische Sozialmedizinerin Alice Stewart ein Projekt zur Erforschung der Ursachen kindlicher Krebserkrankungen begonnen, den Oxford Survey of Childhood Cancer (OSCC). 1957 veröffentlichte sie erstmalig, dass diagnostisches Röntgen bei schwangeren Frauen — was vornehmlich bei Lageanomalien oder Verdacht auf Zwillinge durchgeführt wurde — Leukämie bei den später geborenen Kindern auslöst. Die Untersuchungen wurden fortgeführt. Es ergab sich, dass eine einzige Röntgenaufnahme mit damaliger Dosis — etwa 5 mSv — das Leukämierisiko verdoppelt, also um 100 Prozent erhöht, und dass auch andere Krebserkrankungen im Kindesalter ausgelöst werden.
Diese Befunde wurden jahrzehntelang in der Fachwelt bezweifelt und fanden keine Berücksichtigung in den Risikobewertungen der internationalen Strahlenschutzkomitees wie ICRP und UNSCEAR3 mit dem Argument, sie stünden im Widerspruch zu den Befunden an den japanischen Atombombenüberlebenden.
Im Jahr 1997 erschien dann ein Übersichtsartikel von Doll und Wakeford (langjährige Mitglieder in solchen Komitees), in dem es hieß: „Wir kommen zu dem Schluss, dass Strahlendosen in der Größenordnung von 10 mGy4, die der Fötus im Uterus erhält, einen Anstieg des Krebsrisikos im Kindesalter zur Folge haben.“ Das wurde 2003 bestätigt in einer Analyse von Wakeford und Little mit der Feststellung: „Dieses bedeutet, dass fötale Dosen im Uterus bei 10 mSv das Risiko für Krebs im Kindesalter erkennbar erhöhen.“
Der Report des Komitees der U.S.-amerikanischen Academy of Sciences BEIR5 VII von 2006 bezieht sich auf die letztere Arbeit und kommt in der Zusammenfassung zum Kapitel 7 (Medical Radiation Studies) auf Seite 173 zu dem Schluss:
„Untersuchungen nach vorgeburtlicher Exposition durch diagnostisches Röntgen haben, trotz langanhaltender Kontroverse, bedeutende Informationen über die Existenz eines signifikant erhöhten Risikos für Leukämie und kindliche Krebserkrankungen nach diagnostischen Dosen von 1020 mGy im Uterus geliefert.“
Die ICRP hat in ihrer Publikation 90 von 2003 versucht, die Erkenntnis von Wakeford und Little abzuschwächen, denn ihr Statement in Kapitel 8.10 (Conclusion) lautet wie folgt: „…vom Standpunkt des Strahlenschutzes und der öffentlichen Gesundheitspflege aus, erscheint es umsichtig anzunehmen, dass Exposition im Uterus mit einem nicht-trivialen Risiko verbunden ist…“
Die Debatte um die OSCC-Daten wird in der ICRP-Publikation 103 von 2007 nicht mehr fortgeführt, sondern man verweist dort auf Publikation 90. Das Krebsrisiko nach Exposition im Mutterleib wird, basierend auf den OSCC-Daten, im Kapitel 3.4 als gleich hoch angegeben wie dasjenige nach Exposition im frühen Kindesalter (das wiederum etwa dreimal so hoch wie in der Bevölkerung insgesamt ist). In Annex A.3.2 der Publikation 103 mit der Überschrift „Effects in the embryo and fetus“ wird das Krebsrisiko allerdings nicht genannt.
Dennoch muss man die jetzt breite Anerkennung des OSCC-Befundes als Rückschlag sehen für die Bemühungen der ICRP, in ihrer Publikation 90, die von den Folgen pränataler Bestrahlungen handelt, für diese einen generellen Dosisschwellwert von 100 mSv einzuführen.
II Radon in Häusern und Lungenkrebs
Radon (Rn) ist ein gasförmiges radioaktives Folgeprodukt von Radium, welches Alphastrahlen aussendet. Es befindet sich in der Atmosphäre und trägt damit zur natürlichen Strahlenbelastung des Menschen bei. In Häusern wird es bei geschlossenen Fenstern und guter Isolierung gegenüber außen erheblich angereichert.
Nach Angaben des Bundesamts für Strahlenschutz beträgt die Konzentration des Isotops Rn 222 in Häusern in Deutschland im Mittel etwa 50 Becquerel (Bq) pro Kubikmeter (m3 Bq/m3) Luft und bewirkt damit eine effektive6 Dosis für die Bevölkerung von 0,8 mSv pro Jahr (das ist etwa gleich viel wie die übrige Bestrahlung der Menschen durch natürliche Quellen).
Radium und damit auch Radon sind Folgeprodukte von Uran, daher befindet sich Radon in hohen Konzentrationen in Uranbergwerken, aber auch in anderen Untergrundstollen. Da es erfahrungsgemäß Lungenkrebs bei Bergleuten erzeugt, bestand der Verdacht, dass die Vorkommen in Häusern zum Lungenkrebs der Bevölkerung beitragen.
Anhand der Analysen in 13 epidemiologischen Studien 6 Die Grenzwerte der Strahlenschutzverordnung werden als „effektive“ Dosis angegeben. Diese soll alle Teilkörperbestrahlungen bezüglich der Folgen vergleichbar machen. Zur Ermittlung wird die jeweilige Organdosis je nach Strahlenempfindlichkeit mit einem Organwichtungsfaktor versehen, die Summe aller so gewichteten Teilkörperdosen ergibt die effektive Dosis. aus Europa [Darby et al. 2005] und 7 aus Nordamerika [Krewski et al. 2005] wurde ein dosisproportionaler Zusammenhang zwischen dem Anstieg von Lungenkrebs bei den Bewohnern und der mittleren Radonkonzentration in Häusern festgestellt, der der Dosiswirkungskurve aus den Bergarbeiterstudien entsprach und wiederum keine Schwellendosis aufwies.
 Abbildung 1 zeigt den gefundenen Zusammenhang aus der Arbeit von Darby et al..
Abbildung 1 zeigt den gefundenen Zusammenhang aus der Arbeit von Darby et al..
Die Autoren stellen fest, dass der Effekt auch im Dosisbereich unterhalb von 200 Bq/m³ signifikant ist.
Die 200 Bq/m3 entsprechen einer effektiven Dosis von 3,2 mSv pro Jahr und mit dem Organwichtungsfaktor von 0,12 nach ICRP bedeuten sie eine Lungendosis von 26,7 mSv pro Jahr.
Im Jahr 2009 wurden diese Ergebnisse durch die Weltgesundheitsorganisation WI-lO anerkannt (Fact Sheet No. 291).
Turner und Mitarbeiter bestätigten die Befunde 2011 in einer prospektiven Studie an 820.000 Kanadiern. Sie fanden pro zusätzlichen 100 Bq/m3 Radon in Häusern einen Anstieg für die Lungenkrebssterblichkeit (Mortalität) von 15 Prozent (Darby 16 Prozent; Krewski 11 Prozent; WI-lO 16 Prozent).
III Niederdosiseffekte bei den japanischen Atombombenüberlebenden
Das Referenzkollektiv der ICRP, die Überlebenden der Atombombenabwürfe auf Hiroshima und Nagasaki, wird bis in die Gegenwart in einem japanisch-amerikanischen Institut in Hiroshima, der Radiation Effects Research Foundation (RERF), untersucht.
Mit dem Hinweis auf die besondere Größe dieses KolIektivs (ursprünglich circa 120.000 Personen), und der besonders langen Beobachtungszeit berücksichtigt die ICRP praktisch nur diese Befunde, und schließt Untersuchungsergebnisse aus anderen Studien aus, sofern sie im Widerspruch oder scheinbaren Widerspruch zu denjenigen aus Hiroshima stehen. Etwas differenzierter, aber im Prinzip auf gleiche Weise gehen die anderen wichtigen Strahlenkomitees UNSCEAR und BEIR vor.
Das japanische Kollektiv weist ebenfalls Niederdosiseffekte auf. Die meisten Überlebenden befinden sich nämlich aus geometrischen Gründen (Explosion der Bombe über der Stadt, Abhängigkeit der Dosis von der Entfernung zum Ort der Explosion) in den Niederdosisgruppen. Die mittlere Dosis in der gesamten Kohorte beträgt nur etwa 200 mSv. Die Anzahl Personen in den verschiedenen Dosisgruppen der „Life Span Study“ (LSS) der RERF ist in Tabelle 1 aufgeführt.

Preston und Mitarbeiter analysierten die Daten für solide bösartige Tumoren und setzten dazu verschiedene Formen der Dosis-Wirkungskurve an. Die beste Anpassung ergab sich mit der Annahme des dosisproportionalen Zusammenhangs ohne Schwelle. Nimmt man eine Schwellendosis an, kann diese höchstens bei 40 mSv liegen, es ergeben sich aber keine besseren Fits [Preston et al. 2007]. Der Abstrakt der zugrundeliegenden Arbeit ist im Anhang A wiedergegeben.
Noch genauer wird die Niederdosisfrage von Pierce und Preston 2000 untersucht. Sie verwenden die Daten für solide Tumoren nur im Dosisbereich unterhalb von 500 mSv und kommen zu dem Schluss: „Es gibt einen statistisch signifikanten Effekt im Dosisbereich 0—100 mSv.“ (Vergleiche Anhang B).
In einer Analyse von Dropkin [2007] findet dieser einen signifikanten Krebsanstieg bei den Atombombenüberlebenden im Bereich 0-20 mSv.
IV Strahlenschäden bei beruflich exponierten Personen
In den 1970er Jahren lösten die Befunde von Thomas Mancuso über einen Anstieg multipler Myelome7 bei den Beschäftigten der Atomwaffenfabrik Hanford, USA, erhebliche Debatten in der Fachwelt aus, die er trotz Einhaltung des Grenzwertes — damals 50 mSv pro Jahr — festgestellt hatte. Seine Beobachtungen wurden in Zusammenarbeit mit Alice Stewart und George Kneale bestätigt [Mancuso et al. 1977], und gaben Anlass zu weiteren Untersuchungen.
Im Jahr 1991 veröffentlichten Wing und Mitarbeiter Ergebnisse einer Studie an 17.000 Beschäftigten des Oak Ridge National Laboratory, an dem ebenfalls Kernforschung betrieben wird. Sie fanden ein 10-fach höheres Strahlenrisiko für Krebstod, als nach den Ergebnissen bei den japanischen Atombombenüberlebenden zu erwarten gewesen wäre. Die Beobachtungszeit in der Kohorte betrug im Mittel vom Beginn der Exposition an 26 Jahre. Kendall und Mitarbeiter [1992] fanden erhöhte Krebstodesraten in einer großen Gruppe britischer Nukleararbeiter, die etwa doppelt so hoch waren als nach den japanischen Daten zu erwarten gewesen wäre. Die Autoren hielten das für kompatibel mit letzteren. Die Beobachtungszeit betrug im Mittel jedoch nur 12,8 Jahre.
Seitdem sind zahlreiche Studien aus dem Berufsmilieu durchgeführt worden, die signifikante Effekte im Niederdosisbereich zeigen, darunter auch etliche, denen man das Bemühen anmerkt, die Effekte herunterzuspielen. Es gibt 3 große Probleme, die bei diesen Untersuchungen eine Rolle spielen:
- Der sogenannte „Healthy worker effect“, der auf der Auswahl der Personen für den bestimmten Beruf beruht und bedeutet, dass die Krebsinzidenz8 oder —mortalität (Sterblichkeit) für den nichtexponierten Beschäftigten niedriger ist als im Mittel für die Gesamtbevölkerung. Er kann bis zu 50 Prozent betragen. Daher kommt es auf die Verwendung einer geeigneten Kontrollgruppe an.
- Die meisten strahlenbedingten Krebserkrankungen haben lange Latenzzeiten. Sie beginnen 5 bis 10 Jahre nach Exposition zu steigen und die Erhöhung hält für Jahrzehnte danach an. Studien, bei denen über nur kleine Erhöhungen berichtet wird, sind oft solche, denen eine zu kurze Beobachtungszeit zugrunde liegt. Ein Beispiel ist die 15-Länder-Gemeinschaftsstudie, die von der International Agency for Research on Cancer (IARC) durchgeführt wurde, einer Einrichtung der WHO [Cardis et al. 2007]. Die Beobachtungszeit betrug im Mittel nur 12,8 Jahre.
- Wenn — wie oftmals — die Sterblichkeit (Mortalität) an Krebs und nicht die Erkrankungshäufigkeit untersucht wird, besteht eine hohe Wahrscheinlichkeit zur Unterschätzung des Effekts, weil die Todesursache vom Totenschein entnommen wird. Das kann besonders für solche Krebserkrankungen irreführend sein, die gut therapierbar sind und hohe Überlebensraten haben, wie es zum Beispiel bei bestimmten Lymphomen der Fall ist.
Generell ist jedoch die Fachwelt zu dem Schluss gekommen, dass ein reales Krebsrisiko innerhalb der Dosisgrenzwerte für beruflich Strahlenexponierte existiert. Die schon genannte 15-Länder-Studie über Beschäftigte in der Nuklearindustrie kommt zu dem Ergebnis, dass ein signifikanter Anstieg der Krebsmortalität mit der Dosis besteht. Das kanadische Nationalregister für beruflich Strahlenexponierte findet das ebenfalls und gibt an, dass das Risiko höher ist als in den Auswertungen der RERF aus Japan [Zielinski et al. 2008]. In der 3. Auswertung für britische Nukleararbeiter des dortigen Nationalregisters heisst es, dass die Ergebnisse „die Evidenz für erhöhte Risiken durch solche Expositionen erhärten“ [Muirhead et al. 2009]. Die mittlere akkumulierte Dosis der Beschäftigten auf den am Körper getragenen Dosimetern betrug 24,9 mSv.
V Die verstrahlten Bevölkerungen am FlussTecha, Südural, und im früheren Atomtestgebiet Semipalatinsk
Zur Frage der Wirkungen chronischer Niederdosisexpositionen verweist die vormalige Leiterin der Strahlenabteilung der IARC Elisabeth Cardis neben der 15-LänderStudie auf die Untersuchung der von der sowjetischen Wiederaufarbeitungsanlage Mayak kontaminierten Bevölkerung am Fluss Techa. Diese beiden hält sie außer den Radonbefunden für die epidemiologisch aussagefähigsten Studien [Cardis 2007].
Bei der Aufarbeitung von Kernbrennstoffen zur Gewinnung von Plutonium wurden zwischen 1949 und 1956 massenhaft Spalt- und Brutprodukte in den Fluss Techa geleitet, an dem 25 Dörfer liegen, deren Bevölkerung über die Nutzpflanzen radioaktive Stoffe aufnahmen, vor allem Strontium 90 (Sr 90). Die Untersuchungen erfolgten an 17.400 Personen [Krestinina et al. 2007]. Der Medianwert der Dosis wurde zu 40 mG? bestimmt. Die Dosiswirkungskurven für die Inzidenz solider Tumore zeigten „zweifelsfreie Evidenz für einen dosisabhängigen Effekt“ und annähernd Dosisproportionalität ohne Schwelle.
Ähnlich aussagefähig wird sich die Bevölkerung in Kasachstan erweisen, wo die Sowjetunion im Gebiet Semipalatinsk zwischen 1949 bis 1965 insgesamt 118 oberirdische Atombombentests durchführte. Die Dosen in der betroffenen Bevölkerung wurden zu 20 mSv bis 4.000 mSv ab geschätzt. Die Mortalität für solide Tumoren weist einen signifikanten Anstieg mit der Dosis auf und die Risikoschätzungen liegen höher, als für die japanischen Atombombenüberlebenden abgeleitet wurde [Bauer et al. 2005].
VI Ausstehende Korrekturen
Die Dosis in Sievert soll nach ICRP die „Aquivalentdosis“ darstellen, das heißt sie soll ein einheitliches Schadensmaß für alle Strahlenarten sein. Wenn daher feststeht, dass Effekte im Millisievert-Bereich bei bestimmten Expositionen erwiesen sind, müsste das automatisch auf alle Situationen übertragen werden. Dieser Logik haben sich zum Beispiel die Anwender und offiziellen Begutachter diagnostischer Röntgenstrahlen bislang hartnäckig entzogen, obwohl die Teilkörperdosen zum Beispiel bei einer einzigen CTUntersuchung1° 100 mSv erreichen können und die effektiven Dosen bis zu 25 mSv (www.bfs.de). Außerdem ist den meisten Medizinern nicht bekannt, dass es zahlreiche Arbeiten gibt, die die Spätfolgen diagnostischer Röntgenuntersuchungen belegen; in Anhang C ist eine Liste dazu aufgeführt.
Auch für andere Niederdosisexpositionen gibt es Belege, die bislang keine offizielle Anerkennung gefunden haben. Sie betreffen unter anderem Spätschäden bei Piloten und Stewardessen durch die Höhenstrahlung sowie Röntgenärzte und anderes medizinisches Personal, die an ihren Arbeitsplätzen exponiert werden. Bei den Umweltkontaminationen durch die Atomwaffentests der USA, durch Großbritannien und Frankreich werden nennenswerte Folgen abgestritten.
Ein großer Skandal besteht darin, dass bislang die gesundheitlichen Folgen des Tschernobylunfalls geleugnet werden, bis auf Schilddrüsenkrebs bei Kindern (der als relativ harmlos dargestellt wird, weil überwiegend heilbar) und eine vergleichsweise geringe Gruppe geschädigter Liquidatoren (Aufräumarbeiter). Das UNSCEAR-Komitee, zuständig für die offiziellen Dosisangaben, bedient sich dabei eines beliebten Verfahrens: Man ermittelt theoretisch aufgrund von vereinfachten und unbewiesenen Annahmen eine winzig kleine Dosis und kommt dann zu dem Schluss, dass eine so kleine Exposition keine statistisch erkennbaren Folgen haben kann, und dass eventuell beobachtete Schäden andere Ursachen haben müssen.
Diese Vorgehensweise ist bereits beim Reaktorunfall von Three Mile Island 1979 in den USA und der britischen Wiederaufarbeitungsanlage Sellafield (bezüglich Leukämie bei Kindern und Jugendlichen) angewandt worden. Und dies ist auch die Lesart in Deutschland bei der Auslegung der sogenannten KiKK-Studie, in der 2009 eine systematische Erhöhung von kindlichen Krebserkrankungen bei den deutschen Kernkraftwerken gefunden wurde.
Durch zahlreiche Untersuchungen mit „biologischer“ Dosimetrie (spezifische Chromosomenanomalien) an Personen aus den tschernobylkontaminierten Gegenden bis weit nach Westeuropa ist erwiesen, dass die Dosisangaben von UNSCEAR groteske Unterschätzungen darstellen [Yablokov et al. 2009]. Die dokumentierten Gesundheitsschäden betreffen wie zu erwarten Leukämie und andere Krebserkrankungen sowie solche, die nach ICRP nicht vorkommen dürften, wie Säuglingssterblichkeit und Fehlbildungen bei Neugeborenen, genetische Erkrankungen bei den Nachkommen, Katarakte (Grauer Star) und darüber hinaus viele schwerwiegende Leiden, die man bislang nicht mit Strahlung in Zusammenhang gebracht hat [Pflugbeil et al. 2006, Yablokov et al. 2009].
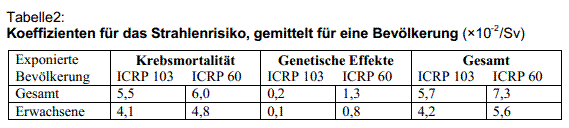
Die ICRP, auf deren Empfehlungen No.60 (von 1991) die deutsche Strahlenschutzverordnung basiert, hat statt dessen die Risikowerte für Spätschäden in ihrer Empfehlung von 2007 (Publikation 103) gesenkt, siehe Tabelle 2.
Als Niederdosiseffekte kommen bei der ICRP nur Krebs und genetische Schäden vor, teratogene Schäden nach Bestrahlung im Mutterleib, die in jedem Lehrbuch für Strahlenbiologie behandelt werden, fehlen wegen des schon erwähnten Schwellwerts von 100 mSv, der ab 2003 gelten soll. Die Angaben in Tabelle 2 erfolgen als Prozent pro Sv und bedeuten für den angegebenen Wert 5,5 in Spalte 2, dass 5,5 Todesfälle erwartet werden, wenn zum Beispiel eine Bevölkerung von 100 Personen mit 1 Sievert bestrahlt wird oder eine Bevölkerung von 100.000 Personen mit 1 mSv. Als Individualrisiko gesehen bedeutet er dasselbe wie eine Wahrscheinlichkeit von 5,5 Prozent, bei einer Dosis von 1 Sv einen strahlenbedingten Krebstod zu erleiden.
Seit den 1980er Jahren haben Kritiker der ICRP ohne Erfolg auf die zahlreichen Einschränkungen hingewiesen, die die Benutzung der japanischen Daten als Referenz für andere bestrahlte Kohorten mit sich bringt, und die durchweg zu einer nennenswerten Unterschätzung der Folgen niedriger Dosen bei Exposition einer normalen westeuropäischen Bevölkerung führt. Bei der Bombenexplosion handelte es sich um eine Blitzbestrahlung, also um eine extreme Kurzzeitexposition, die von der ICRP als 2fach wirksamer eingestuft wird als eine chronische Bestrahlung. Dieses hat sich den vorstehenden Darstellungen zufolge schon lange als Irrtum herausgestellt. Die deutsche Strahlenschutzkommission und das Bundesamt für Strahlenschutz haben empfohlen, den Reduktionsfaktor wegzulassen, also mit doppelt so hohen Risikowerten zu rechnen wie die ICRP.
Ferner war die Bombenstrahlung extrem hochenergetisch, so dass sie strahlenbiologisch als wesentlich weniger wirksam eingeschätzt werden muss [Straume 1995]. Somit sind die Risikoangaben der ICRP allein aus physikalischen Gründen um mindestens den Faktor 4 zu klein. Epidemiologisch entstammen die Atombombenüberlebenden einer Katastrophensituation — Stichwort „Survival of the fittest“ — und natürlich einer anderen Rasse.
Das genetische Strahlenrisiko wurde von der ICRP bis zur Unkenntlichkeit von früher 1,3 auf 0,2 Prozent pro Sv herunter gesenkt (Tabelle 2). Sie argumentiert, es gebe keinen direkten wissenschaftlichen Nachweis dafür, dass Kinder von bestrahlten Eltern Erbkrankheiten haben. Bei den japanischen Atombombenüberlebenden seien keine signifikant erhöhten Erbschäden gefunden worden. Dagegen haben Kritiker immer wieder darauf hingewiesen, dass dort nur eine begrenzte Auswahl an genetischen Merkmalen untersucht werden konnte, da bis heute das gesamte Spektrum mutationsbedingter Schädigungen nicht bekannt ist. Außerdem war die Datenerhebung in Bezug auf die Nachkommen der Bestrahlten besonders unzuverlässig, weil letztere eine gesellschaftlich ausgestoßene und geächtete Population darstellten. Um die Heiratschancen ihrer Kinder nicht zu gefährden, wurde ihre Herkunft möglichst verschwiegen und die potentiellen Schädigungen wurden von den Eltern nicht angegeben [Yamasaki 1990].
Im Gegensatz dazu stehen neben dem großen Spektrum genetischer Erkrankungen nach Tschernobyl Befunde nach beruflicher Exposition sowie diagnostischem Röntgen [Schmitz-Feuerhake 2011].
Um wie viel die ICRP-Werte bei Inkorporation radioaktiver Nuklide zu niedrig liegen, wird letztlich quantitativ kaum zu ermitteln sein, da die Dosimetrie in diesen Fällen nur ungenau sein kann [Dannheim 2000]. Auf jeden Fall ist die Unterschätzung erheblich. Die Aufarbeitung der trotz ihrer enormen Schädlichkeit nicht berücksichtigten Strahlenwirkungen nach Exposition im Mutterleib, bei den Bestrahlten selbst sowie bei ihren Nachkommen muss weiterhin dringend gefordert werden.
Referenzen
Bauer, 5., Gusev, ff1., Pivina, L.M., Apsalikov, K.N., Grosche, B.: Radiation exposure due to local fallout from Soviet atmospheric nuclear weapons testing in Kazakhstan: solid cancer mortality in the Semipalatinsk historical cohort, 1960-1999. Radiat. Res. 164 (2005) 409-419
BEIR VII PHASE 2: Committee to Assess Health Risks from Exposure to Low Levels of lonizing Radiation, Health Risks from Exposure to Low Levels of lonizing Radiation, Nat. Academies Press, Washington DC. 2006, www. nap.edu
Cardis, E. and 52 authors: The 1 5-Country Collaborative Study of Cancer Risk among Radiation Workers in the Nuclear Industry: estimates of radiation-related cancer risks. Radiat. Res. 167 (2007) 396-416
Cardis, E.: Commentary: Low dose-rate exposures to ionizing radiation. lift. J. Epidemiol. 36 (2007) 1046-1047
Dannheim, B., Franke, B., Hirsch, H., Hoffmann, W., Köhnlein, W., Kuni, H., Neumann, W., Schmitz-Feuerhake, 1., Zahrnt,A.: Strahlengefahr für Mensch und Umwelt. Bewertungen der Anpassung der deutschen Strahlenschutzverordnung an die Fordeningen der EU-Richtlinie 96/ 29/Euratom. Berichte des Otto Hug Strahleninstituts Nr. 21-22, 2000, 118 S.
Darby, 5., Hill, D., Auvinen, A., Barros, J.M. et al.: Radon in homes and risk of lung cancer: collaborative analysis of individual data from 13 European casecontrol studies. Brit. Med. J. 330 (2005) 223
Doll, R., Wakeford, R.: Risk of childhood cancer from fetal irradiation. Brit. J. Radiol. 70 (1997) 130-139
Dropkin, G.: Low dose radiation and cancer in A-bomb survivors: Latency and non-linear doseresponse in the 1950-90 mortality cohort. Environ. Health 6:1 (2007). Online-Publ. v. 18.1.2007
ICRP, International Commission on Radiological Protection: Recommendations of the International Commission on Radiological Protection. ICRP Publication 60, Annals of the ICRP 21, No.1-3 (1991) ICRP, International Commission on Radiological Protection: Biological effects after prenatal irradiation (embryo and fetus). ICRP Publication 90. Annals of the ICRP 33, No.1-2 (2003)
ICRP, International Commission on Radiological Protection: fle 2007 Recommendations of the International Commission on Radiological Protection.) ICRP-Publication 103, Ann. ICRP 37 Nos. 2-4 (2007)
Kendall, G.M., Muirhead, C.R., MacGibbon, B.H., O‘Hagan, JA. et al.: Mortality and occu-pational exposure to radiation: first analysis of the National Registry for radiation workers. Br. Med. J. 304(1992)220-225
Krestinina, I.Yu., Davis, F., Ostroumova, EV., Epifanova, S.B. et al.: Solid cancer incidence and bw-dose-rate radiation exposures in the Techa River Cohort: 1956 2002. Int. J. Epidemiol. 36 (2007) 1038-1046
Krewski, D., Lubin, J.H., Zielinski, J.M., Alavanja, M. et al.: Residential radon and risk of lung cancer: a combined analysis of 7 North American case-control studies. Epideniiol. 16 (2005) 137145
Mancuso, T.F., Stewart, A., Kneale, G.: Radiation exposures of Hanford workers dying from cancer and other causes. Health Phys. 33(1977)369-384
Muirhead, C.R., O‘Hagan, JA., Haybock, R.G.E., Phillipson, M.A. et al.: Mortality and cancer incidence following occupational radiation exposure: third analysis of the National Registry for Radiation Workers. Brit. J. Cancer 100 (2009) 206-212
Muller, H.J.: Über die Wirkung der Röntgenstrahlung auf die Erbmasse. Strahlentherapie 55, 1936, 207-224
Pflugbeil, S., Paulitz, H., Claußen, A., Schmitz-Feuerhake, 1.: Gesundheitliche Folgen von Tschernobyl. 20 Jahre nach der Reaktorkatastrophe. In IPPNW, Ges. f. Strahlenschutz eV. Berlin, April 2006, 76 5.
Pierce, DA., Preston, DL.: Radiation-related cancer riks at bw doses among atomic bomb survivors. Radiat. Res. 154 (2000) 17 8-186
Preston, DL., Ron, E., Tokuoka, 5., Funamoto, 5. et al.: Solid cancer incidence in atomic bomb survivors: 1958-1998. Radiat. Res. 168 (2007) 1-64
Schmitz-Feuerhake, 1.: Auch ohne nuklearen Müll und Atomkraftwerke die Verstrahlung der Menschheit schreitet voran. Strahlentelex Nr. 580-581 v. 3. März2011, 8-13
Stewart, A., Webb, J., Hewitt, D.: A survey of childhood malignancies. Brit. Med. J. (1958) 14951508
Straume, T.: High-energy gamma rays in Hiroshima and Nagasaki: implications for risk and wR. Health Physics 69 (1995) 954956
Turner, MC., Krewski, D., Chen, Y., Popo, CA. et al.: Radon and lung cancer in the American Cancer Society cohort. Cancer Epidemiol.Biomarkers Prev. 20 (2011) 438-448
Wakeford, R., Little, M.P.: Risk coefficients for childhood cancer after intrauterine irradiation: a review. Im. J. Radiat. Biol. 79 (2003) 293-309
Wing, S., Shy, C.M., Wood, J.L., Wolf, S. et al.: Mortality among workers at Oak Ridge National Laboratory. JAMA 265 (1991) 1397-1402
Yablokov, A.V., Nesterenko, V.B., Nesterenko, A.V.: Chern-obyl. Consequences of the cata-strophe for people and environ-ment. Ann. New York Acad. Sci. 1181 (2009) 327 Seiten
Yamasaki, J.N., Schull, W.J.: Pe-rinatal loss and neurological ab-normalities among children of the Atomic bomb. Nagasaki and Hi-roshima revisited, 1949 to 1989. JAMA 264 (1990) 605-609
Zielinski, J.M., Shilnikova, N., Krewski, D.: Canadian National Dose Registry of Radiation Workers: overview of research from 1951 through 2007. Int. J. Occ. Med. Environ. Health 21 (2008) 269-275
Anhang A
Radiat Res. 2007 Jul;168(1):1-64.Solid cancer incidence in atomic bomb survivors: 1958-1998.
Preston DL, Ron E, Tokuoka S, Funamoto S, Nishi N, Soda M, Mabuchi K, Kodama K.
Hirosoft International, Eureka, California, USA. preston@hirosoft.net
This is the second general report on radiation effects on the in-cidence of solid cancers (cancers other than malignancies of the blood or blood-forming organs) among members of the Life Span Study (LSS) cohort of Hiroshima and Nagasaki atomic bomb survi-vors. The analyses were based on 17,448 first primary cancers (in-cluding non-melanoma skin can-cer) diagnosed from 1958 through 1998 among 105,427 cohort members with individual dose estimates who were alive and not known to have had cancer prior to 1958. Radiation-associated relati-ve risks and excess rates were considered for all solid cancers as a group, for 19 specific cancer sites or groups of sites, and for five histology groups. Poisson regression methods were used to investigate the magnitude of the radiation-associated risks, the shape of the dose response, how these risks vary with gender, age at exposure, and attained age, and the evidence for inter-site va-riation in the levels and patterns of the excess risk. For all solid cancers as a group, it was esti-mated that about 850 (about 11%) of the cases among cohort mem-bers with colon doses in excess of 0.005 Gy were associated with atomic bomb radiation exposure. The data were consistent with a linear dose response over the 0-to 2-Gy range, while there was some flattening of the dose re-sponse at higher doses. Further-more, there is a statistically signi-ficant dose response when analy-ses were limited to cohort mem-bers with doses of 0.15 Gy or less. The excess risks for all solid cancers as a group and many in-dividual sites exhibit significant variation with gender, attained age, and age at exposure. It was estimated that, at age 70 after ex-posure at age 30, solid cancer ra-tes in-crease by about 35% per Gy (90% CI 28%; 43%) for men and 58% per Gy (43%; 69%) for women. For all solid cancers as a group, the excess relative risk (ERR per Gy) decreases by about 17% per decade increase in age at exposure (90% CI 7%; 25%) after allowing for attained-age effects, while the ERR decreased in pro-portion to attained age to the power 1.65 (90% CI 2.1; 1.2) af-ter allowing for age at exposure. Despite the decline in the ERR with attained age, excess absolute rates appeared to increase throughout the study period, pro-viding further evidence that ra-diation-associated increases in cancer rates persist throughout life regardless of age at exposure. For all solid cancers as a group, women had somewhat higher excess absolute rates than men (F:M ratio 1.4; 90% CI 1.1; 1.8), but this difference disappears when the analysis was restricted to non-gender-specific cancers. Significant radiation-associated increases in risk were seen for most sites, including oral cavity, esophagus, stomach, colon, liver, lung, non-melanoma skin, breast, ovary, bladder, nervous system and thyroid. Although there was no indication of a statistically si-gnificant dose response for cancers of the pancreas, prostate and kidney, the excess relative risks for these sites were also consistent with that for all solid cancers as a group. Doseresponse estimates for cancers of the rec-tum, gallbladder and uterus were not statistically significant, and there were suggestions that the risks for these sites may be lower than those for all solid cancers combined. However, there was emerging evidence from the pre-sent data that exposure as a child may increase risks of cancer ofthe body of the uterus. Elevated risks were seen for all of the five broadly classified histological groups considered, including squamous cell carcinoma, adeno-carcinoma, other epithelial can-cers, sarcomas and other non-epithelial cancers. Althoughthe data were limited, there was a significant radiation-associated increase in the risk of cancer occurring in adolescence and young adulthood. In view of the persisting increase in solid cancer risks, the LSS should continue to provide important new informa-tion on radiation exposure and solid cancer risks for at least an-other 15 to 20 years.PMID: 17722996 [PubMed – in-dexed for MEDLINE]
Anhang B
Radiat Res. 2000 Aug;154(2): 178-86.
Radiation-related cancer risks at low doses among atomic bomb survivors.
Pierce DA, Preston DL.
Radiation Effects Research Foundation, Hijiyama Park, Hiroshima 732-0815, Japan.
To clarify the information in the Radiation Effects Research Foundation data regarding cancer risks of low radiation doses, we focus on survivors with doses less than 0.5 Sv. For reasons indicated, we also restrict attention mainly to survivors within 3, 000 m of the hypocenter of the bombs. Analysis is of solid cancer incidence from 1958-1994, involving 7,000 cancer cases among 50,000 survivors in that dose and distance range. The results provide useful risk estimates for doses as low as 0.05-0.1 Sv, which are not overestimated by linear risk estimates computed from the wider dose ranges 0-2 Sv or 0-4 Sv. There is a statistically significant risk in the range 0-0.1 Sv, and an upper confidence limit on any possible threshold is computed as 0.06 Sv. It is indicated that modification of the neutron dose estimates currently under consideration would not markedly change the conclusions.
PMID: 10931690 [PubMed -indexed for MEDLINE]
Anhang C
Liste der Gesellschaft für Strahlenschutz e.V. von Publikationen ab 1970 über Tumorerkrankungen in Folge diagnostischer Röntgenund nuklearmedizinischer Untersuchungen bei Kindern und Erwachsenen
Gibson, R.,Graham, S., Lilienfeld, AM., Schuman, L., Dowd, J.E., Levin, M.L.: Irradiation in the epidemiology of leukemia among adults. J. Natl. Cancer Inst. 48 (1972) 301-311
Osechinskij, I.V., Shanakina, T.P.: Epidemiological analysis of association between the leukemia and lymphoma incidence and the X-ray diagnostic loads. Problemy Gematologii i Perelivanija Krovi 23 (1978) 13-17, Moskau
Bross, I.D.J., Ball, M., Falen, S.: A dosage response curve for the one rad range: adult risk from diagnostic radiation. Am. J. Public Health 69 (1979) 130-136
Preston-Martin, S., Yu, M.C., Henderson, B.E., Roberts, C.: Risk factors for meningiomas in men in Los Angeles County. J. Natl. Cancer Inst. 70 (1983) 863-6
Davis, F.G., Boice, J.D., Kelsey, J.L., Monson, R.R.: Cancer mortality after multiple fluoroscopic examinations of the chest. J. Natl. Cancer Inst. 78 (1987) 645
Preston-Martin, S., Thomas, D.C.,White, S.C., Cohen, D.: Prior exposure to medical and dental X-rays related to tumors of the parotid gland. J. Natl. CancerInst. 80 (1988) 943-949
Shu, X.O., Gao, Y.T., Brinton, L.A., Linet, M.S., Tu, J.T., Zheng, W., Fraumeni, J.F.: A population-based case-control study of childhood leukemia in Shanghai. Cancer 62 (1988) 635-644
Hoffman, D.A., Lonstein, J.E.; Morin, M.M., Visscher, W., Har-ris III, B.S.H., Boice Jr., J.D.: Breast cancer in women with scoliosis exposed to multiple diagnostic X rays. J. Natl. Cancer Inst. 81 (1989) 1307-1312
Miller, A.B., Howe, G.R., Sherman, G.J., Lindsay, J.P., Yaffe, M.J., Dinner, P.J., Risch, H.A., Preston, D.L.: Mortality from breast cancer after irradiation. N. Engl. J. Med. 321 (1989) 1285-9
Preston-Martin, S., Thomas, D.C., Yu, M.C., Henderson, B.E.: Diagnostic radiography as a risk factor for chronic myeloid and monocytic leukaemia (CML). Brit. J. Cancer 59 (1989) 639-644
Preston-Martin, S., White, S.C.: Brain and salivary gland tumors related to prior dental radiography: implications for current practice. J. Am. Dental. Ass. 120 (1990) 151-158
Neuberger, J.S., Brownson, R.C., Morantz, R.A., Chin, T.D.: Association of brain cancer with dental x-rays and occupation in Missouri. Cancer Detect. Prev. 15 (1991) 31-34
Boice, J.D.Jr., Morin, M.M., Glass, A.G. Friedman, G.D., Stovall, M., Hoover, R.N., Fraumeni, J.F.Jr.: Diagnostic x-ray procedures and risk of leukemia, lymphoma, and multiple myeloma. JAMA 265 (1991) 1290-1294
Shu XO, Jin F, Linet MS, Zheng W, Clemens J, Mills J, Gao YT. Diagnostic X-ray and ultrasound exposure and risk of childhood cancer. Br J Cancer 1994; 70: 531-536
Hallquist, A., Hardell, L., Degerman, A., Wingren, G., Bo-quist, L.: Medical diagnostic and therapeutic ionizing radiation and the risk for thyroid cancer: a case-control study. Eur. J. Cancer Prev. 3 (1994) 259-267
Kaatsch, P., Kaletsch, U., Krummenauer, F., Meinert, R., Miesner, A., Haaf, G., Michaelis, J.: Case control study on childhood leukemia in Lower Saxony, Germany. Klin. Pädiatr. 208 (1996) 179-185
Horn-Ross, P.L., Ljung, B.M., Morrow, M.: Environmental factors and the risk of salivary gland cancer. Epidemiology 8 (1997) 414-419
Wingren, G., Hallquist, A., Hardell, L.: Diagnostic X-ray exposure and female papillary thyroid cancer: a pooled analysis of two Swedish studies. Eur. J. Cancer Prev. 6 (1997) 550-556Yuasa, H., Hamajima, N., Ueda, R.,Ohno, R.: Case-control study of leukemia and diagnostic radiation exposure. Int. J. Hematol. 65 (1997) 251-261
Goldberg, M.S., Mayo, N.E., Levy, A.R., Scott, S.C., Poitras, B.: Adverse reproductive out-comes among women exposed to low levels of ionizing radiation from diagnostic radiography for adolescent idiopathic scoliosis. Epidemiology 9 (1998) 271-278
Rodvall, Y., Ahlbom, A., Pershagen, G., Nylander, M., Spännare, B.: Dental radiography after age 25 years, amalgam fillings and tumours of the central nervous system. Oral Oncol. 34 (1998) 265-269
Morin Doody, M., Lonstein, J.E., Stovall, M., Hacker, D.G., Lukkyanov, N., Land, C.E.: Breast cancer mortality after diagnostic radiography: findings from theU.S. Scoliosis Cohort Study. Spine 25 (2000) 2052-2063
Hardell, L., Mild, K.H., Pahlson, A., Hallquist, A.: Ionizing radiation, cellular telephones and the risk for brain tumours. Eur. J. Cancer Prev. 10 (2001) 523-529
Schmitz-Feuerhake, I., von Boetticher, H., Dannheim, B., Götz, K., Heimers, A., Hoffmann, W., Schröder, H. Estimation of x-ray overexposure in a childhood leukaemia cluster by means of chromosome aberration analysis. Radiat. Prot. Dos. 98 (2002) 291-297
Nienhaus, A., Hensel, N., Ro-scher, G., Hubracht, M., Kaufmann, M., Solbach, C., Krohn, M., Elsner, G.: Hormonelle, medizinische und lebensstilbedingte Faktoren und Brustkrebsrisiko. Geburtsh. Frauenheilk. 62 (2002) 242-249
Harlap, S., Olson, S.H., Barakat, R.R., Caputo, T.A., Forment, S. Jacobs, A.J., Nakraseive, C., Xue, X.: Diagnostic x-rays and risk of epithelial ovarian carcinoma in Jews. Ann. Epidemiol. 12 (2002) 426-434
Shu XO, Potter JD, Linet MS, Severson RK, Han D, Kersey JH, Neglia JP, Trigg ME, Robison LL. Diagnostic x-rays and ultrasound exposure and risk of childhood acute lymphoblastic leukemia by immunophenotype. Cancer Epidemiol Biomarkers Prev 2002; 11: 177-185Infante-Rivard, C.: Diagnostic x rays, DNA repair genes and childhood acute lymphoblastic leukemia. Health Phys. 85 (2003) 60-64
Longstreth, W.T.Jr., Phillips, L.E.,Drangsholt, M., Koepsell, T.D., Custer, B.S., Gehrels, J.A., van Belle, G.: Dental X-rays and the risk of intracranial meningioma: a population-based case-control study. Cancer 100 (2004) 1026-1034
Ronckers, C.M., Doody, M.M., Lonstein, J.E., Stovall, M., Land, C.E.: Multiple diagnostic x-rays for spine deformities and risk of breast cancer. Cancer Epidemiol. Biomarkers Prev. 17 (2008) 605-613
Myles, P., Evans, S., Lophatana-non, A. et al.: Diagnostic radia-tion procedures and risk of pro-state cancer. Brit. J. Cancer 98 (2008) 1852-1856
Prof. Dr. rer. nat. Inge Schmitz-Feuerhake,
ingesf@uni-bremen.de